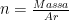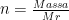a) Definisi Mol
o Satu mol adalah banyaknya zat yang mengandung jumlah partikel yang = jumlah atom yang terdapat dalam 12 gram C-12.
o Mol merupakan satuan jumlah (seperti lusin,gros), tetapi ukurannya jauh lebih besar.
o Mol menghubungkan massa dengan jumlah partikel zat.
Hubungan mol dengan jumlah partikel, Kemolaran, Massa, Volum gas dapat digambarkan sebagai berikut:
o
Jumlah partikel dalam 1 mol (dalam 12 gram C-12) yang ditetapkan
melalui berbagai metode eksperimen dan sekarang ini kita terima adalah
6,02 x 10 23 (disebut tetapan Avogadro, dinyatakan dengan L ).
Contoh :
1 mol air artinya : sekian gram air yang mengandung 6,02 x 10 23 molekul air.
1 mol besi artinya : sekian gram besi yang mengandung 6,02 x 10 23 atom besi.
1 mol asam sulfat artinya : sekian gram asam sulfat yang mengandung 6,02 x 10 23 molekul H 2 SO 4 .
1 mol = 6,02 x 10
23 partikel
L = 6,02 x 10
23
b) Hubungan Mol dengan Jumlah Partikel
Dirumuskan :
Keterangan :
n = jumlah mol
 =
= jumlah partikel
c) Massa Molar (m m )
o Massa molar menyatakan massa 1 mol zat .
o Satuannya adalah gram mol -1 .
o Massa molar zat berkaitan dengan Ar atau Mr zat itu, karena Ar atau Mr zat merupakan perbandingan massa antara partikel zat itu dengan atom C-12.
Contoh :
zAr Fe = 56, artinya : massa 1 atom Fe : massa 1 atom C-12 = 56 : 12
Mr H 2 O = 18, artinya :
massa 1 molekul air : massa 1 atom C-12 = 18 : 12
Karena :
1 mol C-12 = 12 gram (standar mol), maka :
Kesimpulan :
Massa 1 mol suatu zat = Ar atau Mr zat tersebut (dinyatakan dalam gram).
Untuk unsur yang partikelnya berupa atom : m m = Ar gram mol -1
Untuk zat lainnya : m
m =
Mr gram mol
-1
d) Hubungan Jumlah Mol (n) dengan Massa Zat (m)
Dirumuskan :
dengan :
m = massa
n = jumlah mol
m m = massa molar
e) Volum Molar Gas (V m )
o Adalah volum 1 mol gas.
o Menurut Avogadro, pada suhu dan tekanan yang sama, gas-gas bervolum sama akan mengandung jumlah molekul yang sama pula.
o Artinya, pada suhu dan tekanan yang sama, gas-gas dengan jumlah molekul yang sama akan mempunyai volum yang sama pula.
o Oleh karena 1 mol setiap gas mempunyai jumlah molekul sama yaitu 6,02 x 10 23 molekul, maka pada suhu dan tekanan yang sama, 1 mol setiap gas mempunyai volum yang sama.
o Jadi : pada suhu dan tekanan yang sama, volum gas hanya bergantung pada jumlah molnya.
Dirumuskan :
dengan :
V = volum gas
n = jumlah mol
Vm = volum molar
Beberapa kondisi / keadaan yang biasa dijadikan acuan :
1) Keadaan Standar
Adalah suatu keadaan dengan suhu 0 o C dan tekanan 1 atm.
Dinyatakan dengan istilah STP ( Standard Temperature and Pressure ).
Pada keadaan STP, volum molar gas ( V m ) = 22,4 liter/mol
2) Keadaan Kamar
Adalah suatu keadaan dengan suhu 25 o C dan tekanan 1 atm.
Dinyatakan dengan istilah RTP ( Room Temperature and Pressure ).
Pada keadaan RTP, volum molar gas ( V m ) = 24 liter/mol
3) Keadaan Tertentu dengan Suhu dan Tekanan yang Diketahui
Digunakan rumus Persamaan Gas Ideal :

P = tekanan gas (atm); 1 atm = 76 cmHg = 760 mmHg
V = volum gas (L)
n = jumlah mol gas
R = tetapan gas (0,082 L atm/mol K)
T = suhu mutlak gas (dalam Kelvin = 273 + suhu Celcius)
4) Keadaan yang Mengacu pada Keadaan Gas Lain
Misalkan :
Gas A dengan jumlah mol = n 1 dan volum = V 1
Gas B dengan jumlah mol = n 2 dan volum = V 2
Maka pada suhu dan tekanan yang sama :
f) Kemolaran Larutan (M)
Kemolaran adalah suatu cara untuk menyatakan konsentrasi (kepekatan) larutan.
Menyatakan jumlah mol zat terlarut dalam tiap liter larutan, atau jumlah mmol zat terlarut dalam tiap mL larutan .
Dirumuskan :
dengan :
M = kemolaran larutan
n = jumlah mol zat terlarut
V = volum larutan
Misalnya : larutan NaCl 0,2 M artinya, dalam tiap liter larutan
terdapat 0,2 mol (= 11,7 gram) NaCl atau dalam tiap mL larutan terdapat
0,2 mmol (= 11,7 mg) NaCl.
- HUBUNGAN MOL DENGAN JUMLAH PARTIKEL
A. Hubungan Mol (n) dengan Jumlah Partikel (X)
Hubungan antara jumlah mol (
n) dengan jumlah partikel (
X) dalam zat dapat dinyatakan sebagai berikut.
X = n × 6,02 × 1023 Jumlah partikel = mol × 6,02 × 1023
Atau
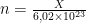
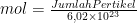 B. Massa Molar
B. Massa Molar
Massa molar (
mm) menyatakan massa yang dimiliki oleh 1 mol zat. Massa 1 mol zat sama dengan massa molekul relatif (
Mr) zat tersebut dengan satuan gram/mol. Untuk unsur yang partikelnya berupa atom, maka massa molar sama dengan
Ar (massa atom relatif) dalam satuan gram/mol.
Contoh:
• Massa molar kalsium (Ca) = massa dari 1 mol kalsium (Ca) =
Ar Ca = 40 gram/mol.
• Massa molar besi (Fe) = massa dari 1 mol besi (Fe) =
Ar Fe = 56 gram/mol.
• Massa molar aluminium (Al) = massa dari 1 mol aluminium (Al) =
Ar Al= 27 gram/mol.
Untuk unsur yang partikelnya berupa molekul dan senyawa, maka massa molar sama dengan
Mr (massa molekul relatif) dalam satuan gram/mol.
Mr = ∑
Ar
dengan:
Mr = massa molekul relatif (gram/mol)
Ar = massa atom relatif (gram/mol)
(James E. Brady, 1990)
Hubungan jumlah mol (
n) dengan massa zat (
m) adalah:
m = n × mm atau
massa = n × Ar atau
massa = n × Mr
dengan:
m = massa zat (gram)
n = jumlah mol (mol)
mm = massa molar =
Ar atau
Mr (gram/mol)
Jadi banyak mol menjadi: